Estructura de Lewis y Cargas Formales, Química Orgánica
Estructura de Lewis
Se representan como puntos situados entre los átomos enlazados, de forma que un par de puntos representa un enlace covalente simple (generalmente se representa por una línea). Un enlace doble se representa por dos pares de puntos, etc. Los puntos que representan electrones de no enlace se colocan adyacentes a los átomos a los que están asociados, pero no entre átomos. Se asignan cargas formales (+, -, 2+, etc.) a los átomos para indicar la diferencia entre la carga nuclear positiva (número atómico) y el número total de electrones sobre la base formal de que los electrones de un enlace están compartidos igualmente entre los átomos que enlazan.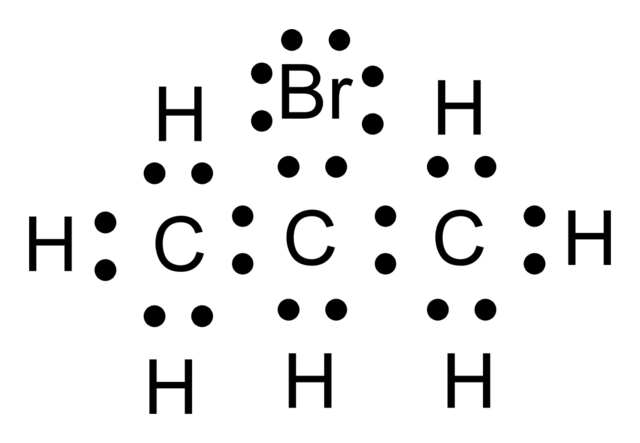
En el establecimiento de las estructuras de Lewis es muy importante tener en cuenta tres aspectos
Cargas Formales
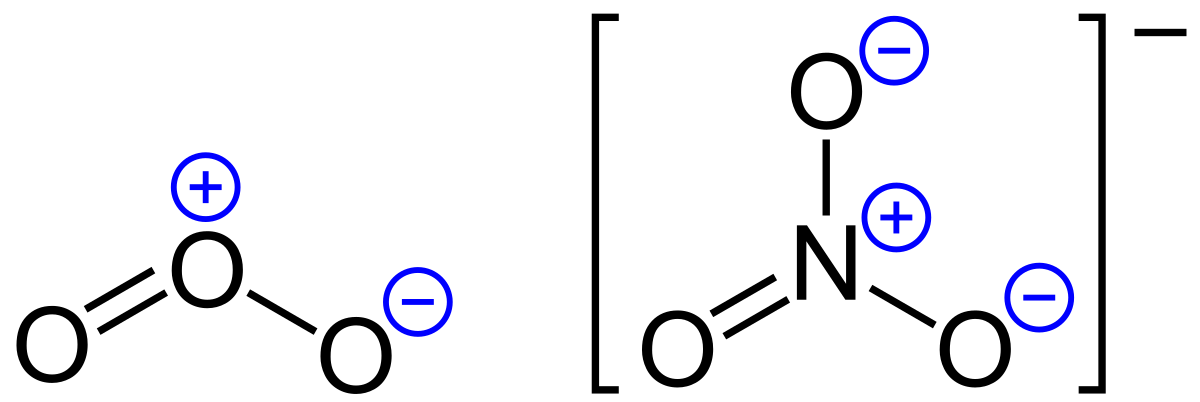
Resonancia
Condiciones para escribir formas resonantes:
Regla del Octeto
Lewis enunció la regla del octeto al observar la
manera en que se combinan entre
sí los elementos. Así, advirtió que todos intentan lograr la configuración
estructural del gas noble que
tienen más cerca en la tabla periódica.
Esta regla presenta numerosas
excepciones, pero sirve para predecir el comportamiento de muchas sustancias.
Concretamente, quedan exceptuados el oxígeno, hidrógeno, nitrógeno, carbono, aluminio,
berilio, boro, flúor, fósforo y el azufre que se
organizan de manera diferente para conseguir la estabilidad en sus compuestos.
El ÁTOMO DE CARBONO
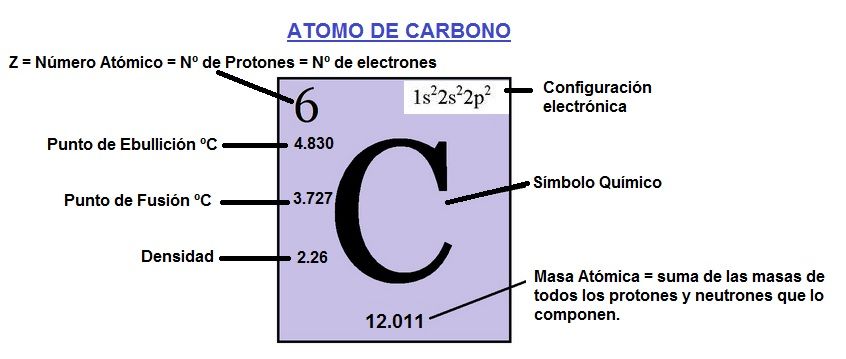
Estructura del Carbono
El átomo de carbono tiene 6 electrones, 4 de los electrones en su capa, órbita o banda de valencia (órbita más externa) y 2 en la capa más interna (más cercana al núcleo).
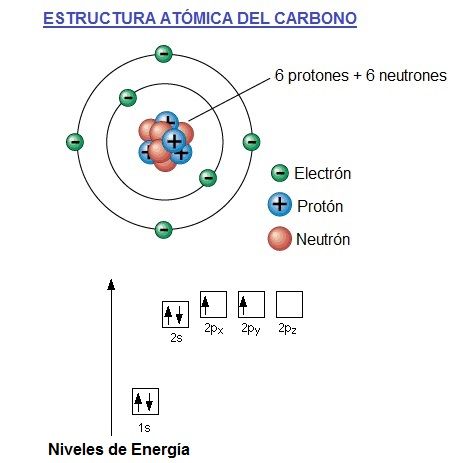
Es una simplificación del átomo de carbono y puede ser engañosa. Da la impresión de que los electrones circulan en torno al núcleo. En realidad, no es posible saber con exactitud dónde se encuentran los electrones.
La dirección de la flecha representa el espín electrónico. El espín es como la representación de la rotación del electrón sobre su eje, ya que no solo gira alrededor del núcleo, también lo hace sobre su propio eje.
ENLACE COVALENTE DEL CARBONO
Los compuestos orgánicos están formados por enlaces covalentes, tienen lugar entre dos átomos de carbono. Existen enlaces simples, que generalmente son los más comunes, pues se encuentra formado por dos electrones, siendo cada uno de uno de los átomos que participan en el enlace.
TEORÍA DEL ORBITAL MOLECULAR
Los enlaces covalentes se forman por una superposición de orbitales atómicos. Enlace Sigma (σ) se superponen dos orbitales s
Enlace pi (π) se superponen lateralmente dos orbitales p
Tipos de Carbono
En química orgánica podemos clasificar los átomos de carbono como Carbono primario secundario terciario o cuaternario, en función del número de átomos de carbono adicionales unidos al átomo de carbono principal.
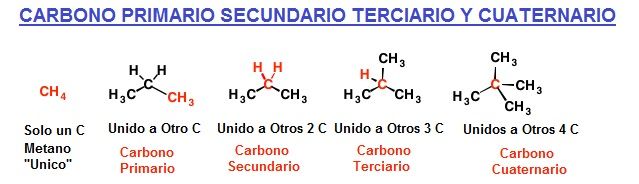
- Carbonos primarios: cuando un átomo de carbono está unido a otro de carbono. (Los hidrógenos, aunque por lo general suelen ser 3, se agrupan en esta tipo).
- Carbonos secundarios: están unidos a otros dos carbonos.
- Carbonos terciarios: están unidos a otros tres carbonos.
- Carbonos cuaternarios: están unidos a otros cuatro carbonos.
- Si solo hay un átomo de carbono se llama «único».
Los isótopos son átomos que tienen el mismo número atómico pero diferentes números de masa. Tienen el mismo número de protones pero diferente número de neutrones.
Los átomos de carbono, tienen mucha facilidad para unirse entre sí y formar cadenas muy variadas. Todos sus átomos forman siempre cuatro enlaces covalentes
→El tipo de hibridación determina la geometría molecular la cual se resume en el siguiente cuadro:
¿Qué es la química orgánica?

Se centra en las sustancias cuyas moléculas disponen del carbono, esto quiere decir que la química orgánica estudia los compuestos con enlaces covalentes carbono- hidrogeno o de otro tipo.
La base de la química orgánica es el carbono, los átomos de este elemento químico disponen de una capa de valencia con los cuatro electrones, para poderla completar debe formar cuatro enlaces con otros átomos, a lo que es llamado regla del octeto
Ejemplo:
Propano (C3H8), metanol (CH3OH), butanona (CH3COCH3), glucosa (C6H12O6), etc.
Excepciones:
CO2, CO, NAHCO3, CaCO3, etc.
Diferencias:
Propiedades | Orgánicos | Inorgánicos |
Fuentes | Pueden extraerse de las materias primas que se encuentran en la naturaleza, de origen animal o vegetal | Se encuentran libres en la naturaleza en forma de sales, óxidos. |
Elementos | Básicos: C,H Ocasiones: O, N, S, y halógenos Trazas: Fe, Co, P, Ca, Zn | Todos los elementos de la tabla periódica |
Enlace predominante | Covalente | Iónico, algunas veces covalente |
Estado Físico | Gases, líquidos o sólidos | Son generalmente sólidos |
Reacciones | Lentas y rara vez cuantitativas | Instantáneas y cuantitativas |
Volatilidad | Volátiles | No volátiles |
Puntos de fusión | Bajos: 300° C | Altos: 700° C |
Solubilidad en agua | No solubles | Solubles |
Solubilidad en solventes orgánicos | Solubles | No solubles |
Aplicaciones de la química Orgánica:
- Bioquímica
- Combustibles
- Plásticos
- Pegamentos
- Medicamentos
- Pinturas
- Alimentos
- Fertilizantes
- Colorantes
- Bebidas
- Perfumes
- Polímeros
- Alcoholes
- Desinfectantes
- Cosméticos
- Pesticidas
- Textiles
Excluye:
- CO
- CO2
- CS2
- CO3-2
- HCO3-
- CN-

Información bien presentada, recordar colocar cada unidad en página del este mismo blog,
ResponderBorrar