3ra Unidad
¿Qué son los alcanos?
Son compuestos orgánicos del grupo de los Hidrocarburos, es decir, que están formados únicamente por átomos de carbono e hidrógeno.
Lo que diferencia a los Alcanos del resto de Hidrocarburos es que sus átomos de carbono están unidos por enlaces sencillos.
Un compuesto químico formado a partir de la combinación de carbono e hidrógeno. En este caso, se trata de un hidrocarburo saturado, ya que sus enlaces covalentes son sencillos.
-De los alcanos se puede decir que son insolubles en el agua.
-El principal uso que se les suele dar es como combustibles. ¿Por qué? Porque, de manera incuestionable, liberan una gran cantidad de calor.
-Por regla general, los alcanos se dividen en cuatro grupos diferenciados: cíclicos, lineales, policíclicos y ramificados.
-Sus puntos de ebullición y también de fusión son bajos.
-No son rígidos.
-A la hora de analizar, trabajar y utilizar alcanos cobran especial importancia y valor desde lo que es su combustión hasta los conocidos diagramas de energía potencial. De la misma manera, no podemos olvidarnos tampoco de lo que se conoce como proyección de Newman. Esta sirve para comprobar la energía de las conformaciones posibles que tienen lugar.
s importante destacar que se han encontrado alcanos en otros planetas. Los planetas gaseosos suelen presentar alcanos en su atmósfera, como Urano, Neptuno, Saturno y Júpiter. En meteoritos que han caído a la superficie de la Tierra también se ha detectado la presencia de alcanos.
Los alcanos tienen múltiples usos. Es posible emplear ciertos alcanos para producir electricidad o como combustible para calefaccionar e impulsar motores. Los alcanos además sirven para obtener aceites. El uso de los alcanos debe controlarse ya que se trata de un compuesto que, al mezclarse con el aire, puede explotar.
Hidrocarburos Alifáticos Saturados
Los hidrocarburos son compuestos formados exclusivamente por átomos de carbono e hidrógeno. Se obtienen a partir del petróleo o del gas natural mediante destilación fraccionada. Se dividen en: alifáticos, cíclicos y aromáticos. El carácter de aromaticidad se debe a la existencia de dobles enlaces conjugados en anillos cíclicos. Son saturados los hidrocarburos alifáticos cuyos átomos de carbono están unidos entre sí por enlaces sencillos.
Los hidrocarburos alifáticos saturados responden a la fórmula general CnH2n+2 , donde n es el número de átomos de carbono. Se nombran según el número de átomos de carbono de la cadena, terminados en -ano.
CH4 metano CH3?CH3 etano
CH3?CH2?CH3 propano
CH3?CH2?CH2?CH3 butano
CH3?CH2?CH2?CH2?CH3 pentano
Los compuestos, como los de arriba, con el mismo grupo funcional pero distinto número de átomos de carbono en la cadena, forman una serie homóloga.
Cuando el hidrocarburo pierde un hidrógeno, queda un radical. Éste recibe la misma denominación que el hidrocarburo del que procede, pero terminado en -ilo, si se dice el nombre aislado, y en -il, si se dice formando parte de un compuesto:
CH3? metilo
CH3?CH2? etilo
CH3?CH2?CH2? propilo
Las principales propiedades de los hidrocarburos saturados son:
Los puntos de fusión y ebullición aumentan con el número de átomos de carbono. Los valores más bajos corresponden a los hidrocarburos de cadena ramificada.
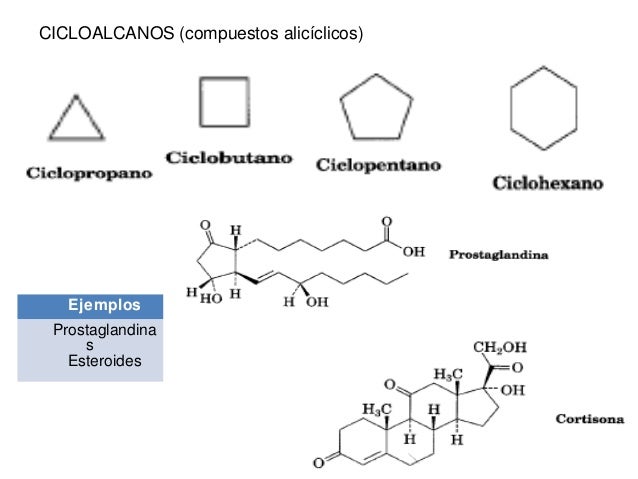
Cicloalcanos

Son hidrocarburo saturados, cuyo esqueleto está formado únicamente por átomos de carbono unidos entre ellos con enlaces simples en forma de anillo. Su fórmula genérica es CnH2n. Por fórmula son isómeros de los alquenos. También existen compuestos que contienen varios anillos, los compuestos policíclicos. Pueden presentar cadenas lineales.
Son alcanos que contienen anillos de átomos de carbono. Muchos
compuestos orgánicos presentes en la naturaleza son cíclicos, por ejemplo los
monoterpenos, con 10 átomos de carbono, están presentes en muchas esencias de
las plantas.
Nomenclatura
Se llama nomenclatura química a un sistema de reglas que permite dar nombre a los diferentes compuestos químicos según el tipo y número de elementos que los componen. La nomenclatura permite identificar, clasificar y organizar los compuestos químicos.
El propósito de la nomenclatura química es asignar a las sustancias químicas nombres y fórmulas, llamados también descriptores, de manera que sean fácilmente reconocibles y se pueda consolidar una convención.
Dentro de la nomenclatura química, se distinguen dos grandes grupos de compuestos:
Compuestos orgánicos, referidos a aquellos con presencia de carbono enlazado con moléculas de hidrógeno, oxígeno, azufre, nitrógeno, boro y ciertos halógenos;
Compuestos inorgánicos, que se refieren a todo el universo de compuestos químicos que no incluyen moléculas de carbono.
Tipos de nomenclatura química
Existen tres sistemas de nomenclatura química:
- Sistema de nomenclatura tradicional, funcional o clásico.
- Sistema de nomenclatura sistemática o estequiométrica.
- Sistema de nomenclatura Stock.
Estereoquímica de alcanos y cicloalcanos
Los alcanos son hidrocarburos saturados en los cuales todos los enlaces carbono-carbono son enlaces simples. Se dice saturados porque contiene la cantidad máxima de hidrógenos por carbono. Los cicloalcanos son alcanos en los cuales los átomos de carbono están unidos formando un anillo.
Son la primera clase de hidrocarburos simples y contienen sólo
enlaces sencillos de carbono‐carbono. Solo poseen carbono e
hidrogeno y no tienen grupos funcionales.
ALCANOS
Los alcanos comparten muchas p p ro iedades en común. Todos entran en reacciones de combustión con el oxígeno para producir dióxido de carbono y agua de vapor. En otras palabras, muchos alcanos son inflamables. Esto los convierte en buenos combustibles.
Los alcanos son hidrocarburos saturados en los cuales todos los enlaces carbono‐carbono son enlaces simples. Se dice saturados porque contiene la cantidad máxima de hidrógenos por carbono.
Cicloalcanos
Las estructuras en forma de anillos de los ciclos alcanos añaden limitaciones a la conformación molecular. El movimiento queda mas restringido que en moléculas aciclicas, conduciendo a repulsiones
debidas a deformaciones de los ángulos de enlace del esqueleto cíclico.
Todos los enlaces carbono‐carbono están eclipsados, generando una tensión torsional que contribuye a la tensión total del anillo.
La tensión angular y la tensión torsional en el ciclopropano hacen que este anillo sea extremadamente reactivo.

Falta la parte de isomeria, debe colocar cada unidad en página por separado, falta agregar ejemplos de nomenclatura
ResponderBorrar